Bærum CFS/ME og borreliose klinikk
Dag Gundersen Storla - fagområder og kompetanse
Etter reise
Har arbeidet i Bangladesh gjennom flere år og har kompetanse på utredning av uavklarte tilstander etter opphold i tropene.
MUPS
Betyr Medisinsk Uforklarte Plager og Symptomer. Dette har lenge vært et interessefelt. Redaktør av boken "Diffusitas - når legen står fast". Vi foretar en indremedisinsk utredning ut fra en helhetlig tilnærming.
CFS/ME
Kompetanse opparbeidet blant annet ved tidligere tilknytning til nasjonal kompetansetjeneste for CFS/ME.
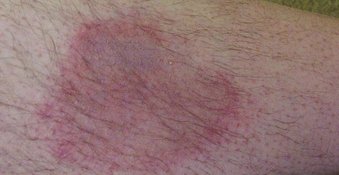
Borreliose
Spesialist i infeksjonssykdommer med lang erfaring i utredning og behandling.
KRONISK UTMATTELSE - ME
Hver fjerde pasient som oppsøker fastlegen, har en eller annen form for utmattelse. Etter forskjellige forsøk på utredning puttes disse pasientene ofte i en stor «sekk» sammen med alt det man ikke forstår, men antar har psykosomatiske årsaksmekanismer. Men hvordan skiller man ut dem som har genuint kronisk utmattelsessyndrom - CFS /myalgisk encefalopati - ME ? Den sentrale sykdomsmekanismen er ennå ikke bevist, men det er udiskutabelt at det foreligger en utbredt aktivering av immunsystemet og nervesystemet. Ettersom man ennå ikke har tilstrekkelige biomarkører, er CFS/ME en eksklusjonsdiagnose; en lang rekke tilstander kan fremstå med et lignende klinisk bilde. Derfor er en grundig og eksakt differensialdiagnostikk avgjørende.
Litt historikk
Det finnes vitnesbyrd om at mennesker til alle tider har blitt rammet av uforklarlig utmattelse (1). På 1800-tallet lanserte den amerikanske nevrologen Georg Miller Beard (1839–1883) nevrasteni som diagnose og begrep. Han mente å se et mønster hos mange pasienter som slet med utmattelse, angst, hodepine, impotens, nevrogene smerter og depresjon. Hanmente å se et syndrom som oppsto som et resultat av den moderne sivilisasjon, og spesielt vår konkurransementalitet. Beard observerte dette symptombildet særlig hos mennesker med høye ambisjoner. Ofte var de på et punkt i livet der de ikke klarte å leve opp til sine egne forventninger. I tillegg beskrev han at nevrasteni ble utløst av en kortvarig fysisk sykdom som for eksempel en infeksjon (2). Det er iøynefallende at en så moderne forklaringsmodell ble lansert så tidlig. Minst like interessant er det at Beard fant at utmattelsen ofte ble utløst av infeksjoner, noe som kjennetegner et flertall av tilfellene av det vi definerer som myalgisk encefalopati i dag. Nevrasteni ble likevel raskt definert som en psykosomatisk lidelse som man avgrenset i forhold til postviralt utmattelsessyndrom. Og i denne båsen har nevrasteni blitt værende like til i dag; i ICD-10 klassifiseres diagnosen under F48 – andre nevrotiske tilstander. Fra mellomkrigstiden og fremover har det vært publisert en rekke artikler om tilstander med et CFS/ME-lignende bilde, ofte karakterisert som utbrudd. I 1938 beskrev Alexander Gilliam en poliomyelitt-lignende epidemi der nesten samtlige leger og sykepleiere ved et Los Angeles-sykehus var rammet. Han beskrev symtomer som fatigue, sensoriske utfall, muskelstivhet, vasomotoriske symptomer og raskt progredierende muskelsvakhet (3). Det er rapportert lignende klynger av tilfeller med varierende grad av likhet i symptombildet i Australia, Sveits, Island, Danmark, England og Sør-Afrika under navn som «Akureyri disease», «encephalitis», «simulating poliomyelitis», «Iceland disease», «abortive poliomyelitis» og «royal free» (4, 5). Man kan i ettertid spekulere i hva som skjulte seg bak disse fenomenene, kanskje var epidemiene utløst av forskjellige mikrober eller ulike former for massehysteri. Basert på patologiske forandringer i hjernen hos både aper (6) og mennesker (7) mente man etter hvert at tilstanden skyldtes en betennelse i sentralnervesystemet, spesielt i de afferente nerverøttene. Det ble fremsatt teorier om at det kunne dreie seg om en form for encefalitt som etter hvert fikk navnet myalgisk encefalitt eller encefalopati – ME (8). Den nasjonale veilederen bruker konsekvent myalgisk encefalopati. Et annet navn som fortsatt brukes, er chronic fatigue syndrome (CFS), som det nå er enighet om at er et annet navn på samme tilstand. Nylig ble SEID – systemic exertion intolerance disease – lansert som en bedre betegnelse. Den nasjonale veilederen bruker CFS/ME som standardforkortelse, og denne forkortelsen er allerede blitt godt innarbeidet.
Den første grovsorteringen
En hensiktsmessig tilnærming kan være å foreta en grovsortering i fire kategorier:
•CFS/ME
•andre somatiske lidelser
•psykosomatiske lidelser
•idiopatisk kronisk utmattelse
Idiopatisk kronisk utmattelse er det legen står igjen med når han ikke kan plassere pasienten i noen av de tre andre kategoriene (9).
Årsaker og utløsende faktorer
En oversiktsartikkel fra den anerkjente Mayoklinikken i USA oppsummerer det vi vet om årsaksmekanismene bak CFS/ME på en god måte, og de neste punktene er basert på denne. Referansene i denne artikkelen er ikke tatt med av plasshensyn, men finnes der artikkelen er publisert på https://www.mayoclinicproceedings.org/article/S0025-6196(21)00513-9/fulltext
UVELHET ETTER ANSTRENGELSE OG SVEKKET ENERGIMETABOLISME
Hos både friske og syke mennesker forbedrer vanligvis fysisk trening tretthet, søvn, smerte, tankevirksomhet og humør. Pasienter med CFS/ME opplever derimot en utmattelse etter anstrengelse som ikke står i forhold til anstrengelsen, det som kalles PEM (Post Exertional Malaise – anstrengelsesutløst symptomforverring). Det som pasienten tidligere tolererte av fysiske, kognitive, emosjonelle eller sensoriske stressfaktorer takler hun ikke lenger, og meget små anstrengelser kan utløse langvarig utmattelse. Mens kronisk inaktive mennesker sannsynligvis er dekondisjonerte, forklarer ikke dekondisjonering symptomene på CFS/ME. I stedet tyder flere studier på at problemer med å generere og bruke hovedenergimolekylet, adenosintrifosfat (ATP)er en grunnleggende årsak til CFS/ME. Når stillesittende, men friske mennesker, eller personer som er rammet av en kronisk sykdom blir bedt om å trene til sin maksimale yteevne i to dager etter hverandre går ikke oksygenopptaket i muskulaturen ned, som oftest stiger yteevnen. Kronisk syke tar kanskje ikke opp oksygen like effektivt som friske, fysisk spreke mennesker, men yteevnen deres forblir den samme ved gjentatte tester. Ved CFS/ME forringes evnen til å generere energi på dag 2. I en studie falt den anaerobe terskelen (når musklene går over til å produsere melkesyre) med opptil 55 %. Andre studier har rapportert høye nivåer av melkesyre eller økt acidose i blod, cerebrospinalvæske og muskler. Dette kan skyldes økt produksjon eller redusert eliminering. Hvis aerob metabolisme (den normale celleåndingen som finner sted når det er nok oksygen tilstede) er svekket, bytter cellene til anaerobe (uten oksygen tilstede) måter å skaffe energi på i stedet. Når det produseres melkesyre får kroppen tilført 18 ganger mindre ATP per glukosemolekyl. I tillegg har mennesker med en alvorlig grad av CFS/ME også nedsatt evne til å frigjøre glukose når de trenger det (nedsatt evne til glykolyse). Disse endringene kan forklare hvorfor ME-syke har problemer med å utføre oppgaver de klarte med letthet før de ble utmattet. Ved CFS/ME foreligger det forstyrrelser i mange energiproduksjonssystemer samtidig. Tomas og Newton og Rutherford et al. har skrevet gode oppsummerende artikler om dette.
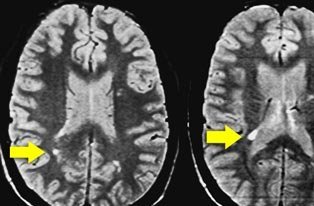
ENDRINGER I HJERNEFUNKSJON OG IMMUNFORSVAR
Anstrengelse er også assosiert med endringer i hjernefunksjon og immunforsvar. Ved å bruke funksjonell magnetisk resonansavbildning (funksjonell PET-scanning), fant Cook et al. at endret hjerneaktivitet fulgte symptomforverring etter anstrengelse og nedsatt kognitiv funksjon. Maes et al. fant at PEM er assosiert med økte nivåer av interleukin-1, og Nijs et al. fant økt komplementaktivitet, oksidativt stress og økt genuttrykk av interleukin-10. Både slike økte nivåer av proinflammatoriske signalmolekyler i hjernen som interleukin-1 og interleukin-10 og PET-scan resultater tyder på en omfattende neuroinflammasjon, som er den sannsynlige årsaken til symptomer som tretthet, smerte, influensalignende følelser og kognitiv svikt. Disse objektive endringene blir tydeligere og mer omfattende desto mer omfattende pasientens PEM og hjernetåke fremstår.
UFORFRISKENDE SØVN
ME-syke opplever ulike søvnforstyrrelser, for eksempel problemer med å falle i søvn eller holde seg i søvn. Men selv når disse problemene behandles, forblir de fleste trøtte eller syke når de våkner. Redusert hjertefrekvensvariasjon, kontrollert av det autonome nervesystemet, er knyttet til lite forfriskende søvn, en sammenheng man finner ikke bare ved CFS/ME men også ved andre søvnforstyrrelser. Videre har studier rapportert at nattlig parasympatisk aktivitet er redusert i forhold til sympatisk aktivitet ved CFS/ME, det motsatte av hva bør forekomme under hvile.
KOGNITIV SVEKKELSE OG HJERNETÅKE
Redusert informasjonsbehandlingshastighet er det mest vanlige kognitive problemet ved CFS/ME. Andre abnormiteter inkluderer redusert reaksjonstid, arbeidsminne og oppmerksomhet. Disse problemene skyldes ikke dårlig innsatsvilje, søvnløshet eller stemningslidelser. Det blir særlig ille når man møter tidsfrister, uopphørlige krav og flere samtidige oppgaver. Motorisk hastighet, verbale ferdigheter og evne til overordnede resonnementer forblir intakt. Som nevnt har hjernestudier funnet omfattende hjernebetennelse og redusert aktivitet i hvit substans, muligens også i grå substans.
ORTOSTATISK INTOLERANSE OG AUTONOM SVIKT
Hos opptil 95 % av de med CFS/ME vil det å reise seg opp eller bli langvarig stående eller sittende forårsake eller forverre symptomer som svimmelhet, kvalme, tretthet, hjertebank og kognitiv svikt.
Dette fenomenet kalles ortostatisk intoleranse og inkluderer ortostatisk hypotensjon, posturalt ortostatisk takykardisyndrom (POTS) og neuralt mediert hypotensjon.
Objektive fysiologiske abnormiteter inkluderer følgende:
- Unormale puls- og blodtrykksendringer etter passiv stående og vippebordtester.
- Et 25 % fall i cerebral blodstrøm når testpersonen står eller sitter opp.
- Nedgang i slagvolumindeks og hjerteindeks som ikke er korrelert med aktivitetsnivåer stemmer ikke med teorier om at dekondisjonering (dårlig form) forklarer CFS/ME.
- Ortostatisk hypokapni (lavt nivå av karbondioksyd) og en reduksjon i blodvolum er med på å ytterligere forverre de ovenfor nevnte symptomene forårsaket av forstyrrelser i det autonome nervesystemet.
- Gastrointestinale, urin-, termoregulatoriske og visuelle problemer har også blitt rapportert, men har ikke blitt grundig studert.
NEDSATT IMMUNFUNKSJON
Samtidig som pasienten har kronisk immunaktivering har hun også nedsatt immunfunksjon, slik man ofte ser ved autoimmune sykdommer. Når kroppen bruker kapasiteten i immunforsvaret til å angripe seg selv, blir det mindre igjen til forsvar mot ytre fiender. I gjennomsnitt er den naturlige NK (natural killers) celleaktiviteten lavere hos ME-syke enn hos friske kontroller. Det er ukjent om dette funnet er en årsak til eller konsekvens av CFS/ME. Selv om pasienter med CFS/ME ikke har symptomatiske, opportunistiske infeksjoner (f.eks. kryptosporidiose, tuberkulose), opplever noen tilbakevendende herpesinfeksjoner. Noen har økt mottakelighet for banale virusinfeksjoner som ved forkjølelse og kan ta lengre tid å komme seg etter infeksjoner, mens andre opplever generelt høyere infeksjonstendens. En fjerdedel kan ha reduserte immunglobuliner (92) eller ha problemer med å kontrollere Epstein-Barrvirusinfeksjoner. Studier har også rapportert unormale endringer i T-celler og cytokiner.
INFEKSJON
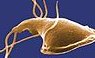
Myalgisk encefalomyelitt/kronisk utmattelsessyndrom følger ofte etter en infeksjonssykdom, men den spesifikke mikroorganismen blir ofte ikke identifisert fordi sykdommen i utgangspunktet så ut til å være selvbegrenset. Andre ganger følger CFS/ME en godt dokumentert infeksjonssykdom, som Epstein-Barrvirus (infeksiøs mononukleose) eller Giardia-forårsaket diaré. Hos mange pasienter med CFS/ME kan man se reaktivering av ulike latente infeksjoner (som Epstein-Barr-virusinfeksjon), men det er uklart om de forårsaker symptomer eller bare reflekterer et undertrykt eller «distrahert» immunsystem. Det er mye som tyder på at CFS/ME er et resultat av en infeksjonsutløst autoimmun respons – at CFS/ME er en autoimmun sykdom.
OPPSUMMERING AV MITT SYN PÅ CFS/ME
Det er tre ting som ofte foreligger når CFS/ME bryter ut:
For det første foreligger det en genetisk sårbarhet. Kvinner rammes oftere enn menn [16], CFS/ME har opphoping i visse familier og tvillingstudier bekrefter genetisk disposisjon [17]. Ved Single-NucleotidePolymorfisme (SNP) har man for eksempel funnet CFS/ME-spesifikke profiler rundt alleler som NR3C1_11159943 (regulerer HPA-aksen og sårbarhet for autoimmun sykdom) og 5HTT_7911132
(assosiert med nedsatt serotinerg transmisjon) [18], glutamat reseptor ionotropisk kinase 2 (GRIK2) (regulerer glutaminerg transmisjon) og neuronalt PAS domain protein 2 (NPAS2) (involvert i søvnrytme via circadin) [19]. Det foregår en ekstensiv videre kartlegging.
For det andre foreligger det ofte en betydelig økt livsbelastning og stress. Det ser ut som om perfeksjonisme øker sykdomsrisikoen [20]. Risikoen øker også dersom det foreligger alvorlige barndomstraumer eller PTSD (posttraumatisk stresslidelse). Flere studier bekrefter det man ofte erfarer klinisk, at det ofte foreligger stressende livshendelser i månedene forut for debut av sykdommen [21].
For det tredje kan man som regel identifisere en utløsende faktor, en trigger. Mange tenker seg at CFS/ME utløses når det foreligger både en genetisk sårbarhet, en livssituasjon med betydelig stress og en akutt utløsende faktor. En rekke virus-, bakterie- og parasittinfeksjoner er assosiert med sykdomsdebut [22], i Norge ser man særlig CFS/ME etter mononukleose [23], influensa [24] og atypiske pneumonier [25]. Det foreligger også andre triggere som for eksempel fødsel, fysisk traume eller vaksinasjon. En god forelesning (fra Folkehelseintituttets årskonferanse for CFS/ME 2021) om emnet finnes også på:
På vei mot anvendelige biomarkører
Flere forskningsmiljøer har funnet frem til biomarkører med høy sensitivitet og spesifisitet. Fortsatt gjenstår oppfølgingsstudier og verifiseringsarbeid, men det er ikke lenger et sprøsmål OM biologiske tester for CFS/ME kommer, men NÅR. Her nevner jeg kort tre av dem:
1.NEDSATT TRP M3 RESEPTORFUNKSJON
TRP M3 reseptoren sitter på immunceller, som er viktig for transport av kalsium inn og ut av cellene. Kalsiumtransport er viktig for cellenes evne til å reagere på belastninger («stress» på engelsk betyr alle former for belastning)– som vibrasjoner, strekk, skade eller temperatursvingninger. Reseptoren finnes på alle celler i kroppen. Don Staines og hans australske forskergruppe mener at nedsatt funksjon sannsynligvis er årsaken til alle symptomene ved ME, og brukt som biomarkør skiller den godt mellom CFS/ME pasienter og friske kontrollpersoner (57).
2. SALTVANNSTESTEN
Ron Davis og hans forskergruppe ved Stanford, USA brukt en liten «nanoneedle» til å måle endringer i elektriske signaler i immunceller i plasma. De tilførte saltvann slik at cellene ble stresset. Celler fra ME-syke oppførte seg forskjellig fra celler fra friske kontrollpersoner. Testen kunne skille ME-syke fra kontrollene med nær 100 % nøyaktighet (58)
3. FORSTYRRELSER I METABOLSKE PROSESSER
Germain og hans forskergruppe undersøkte 361 forskjellige metabolske prosesser (pathways). De fant at 74 forskjellige metabolitter deponerte seg i kroppen til CFS/ME pasienter. Bak disse 74 kunne man påvise at 35 metabolske prosesser hos CFS/ME pasienter var signifikant endret i forhold til friske kontrollpersoner. Disse 35 prosessene kan knyttes nært til den generelle mangelen på energi observert hos ME/CFS pasienter:
- Taurin- og glyserofosfolipidmetabolisme, gallesyremetabolisme, samt glyoksylat- og dikarboksylatmetabolisme og fettsyre metabolisme.
- Puriner, inkludert ADP og ATP, pyrimidiner og flere metabolske aminosyrestier, ble funnet å være betydelig forstyrret.
- Glukose og oksaloacetat; to hovedmetabolitter som ble påvirket og som har stor innvirkning på sukker og energinivå.
Til sammen kunne forskjellene i disse 35 metabolske prosessene skille mellom CFS/ME pasienter og friske kontroller med høy spesifisitet og sensitivitet (59).
Nye internasjonale kriterier for CFS/ME (ICC)
I 2011 ble det opprettet et internasjonalt konsensuspanel for å komme frem til nye kriterier. Målet var å gjøre det lettere å stille diagnosen på et mer objektivt grunnlag (30). Noen av de eksisterende kriteriesystemene er så uspesifikke at man ender opp med store, ikke-homogene pasientgrupper. Andre systemer avgrenser sannsynligvis ME-diagnosen i for stor grad. For eksempel har det amerikanske Centers for Disease Control and Prevention (CDC) regnet seg frem til at prevalensen av ME i befolkningen blir tidoblet om man i stedet for de restriktive canadiske kriteriene (30) (0,24 %) bruker de empiriske Reeveskriteriene (31) (2,54 %). Noen hevder at feilen med Reeves’ kriterier er at det går an å tilfredsstille disse uten å ha fysiske symptomer. Det er derfor for eksempel vanskelig å skille mellom CFS/ME og pasienter med en depressiv lidelse. Men også enkelte av Canada-kriteriene overlapper med symptomer på depresjon. For å tilfredsstille de canadiske kriteriene må pasienten i tillegg ha klare symptomer på fysisk og kognitiv svekkelse. De nye internasjonale konsensuskriteriene brukte de canadiske kriteriene som utgangspunkt. Disse hadde empirisk vist seg å være gode til å skille genuine ME-pasienter fra den mye større gruppen av pasienter med kronisk utmattelse knyttet opp mot depresjon og psykosomatiske problemstillinger. Allikevel opplevde man for eksempel ved CFS/ME-senteret ved Oslo universitetssykehus Aker, som er knyttet til nasjonal kompetansetjeneste for CFS/ME, at opptil 40 % av de pasientene som tilfredsstilte de canadiske kriteriene, ikke tilfredsstilte de nye internasjonale kriteriene. Dette skyldtes en uheldig sammenstilling av kravene. Det arbeides nå med en revisjon. Inntil videre anvender vi de canadiske kriteriene fra 2003 (32).
De canadiske kriteriene for CFS/ME (2003)
1 Utmattelse
Pasienten har en betydelig grad av ny, uforklarlig, vedvarende eller tilbakevendende fysisk og mental utmattelse som i vesentlig grad reduserer daglig aktivitetsnivå (minst 50 %).
2 Anstrengelsesutløst sykdomsfølelse og/eller utmattelse
Det foreligger et unormalt tap av fysisk og mental utholdenhet, rask muskulær og kognitiv trettbarhet, anstrengelsesutløst sykdomsfølelse. Man ser også utmattelse, smerter og en tendens til forverring av andre symptomer. Dagligdagse ting som et familieselskap, et foreldremøte eller en kort gåtur kan gi en patologisk lang restitusjonsperiode på 24 timer eller mer.
3 Søvnforstyrrelser
Det foreligger ikke-forfriskende søvn, forstyrrelser i søvnlengde eller søvnrytme, slik som reversert eller kaotisk døgnrytme.
4 Smerter
Det typiske er betydelige myalgier, ofte kombinert med smerter i flere ledd. Både muskel- og leddsmertene er vandrende av natur, og fokus skifter stadig. Vanligvis får pasienten også hodepine som oppleves annerledes enn tidligere både når det gjelder mønster og intensitet.
5 Nevrologiske og kognitive symptomer
To eller flere av følgende symptomer skal være til stede:
• Forvirring
• Svekket konsentrasjonsevne og korttidshukommelse
• Desorientering, vanskeligheter med å bearbeide og kategorisere informasjon og å finne ord
• Perseptuelle og sensoriske forstyrrelser, for eksempel varierende romsans og synsforstyrrelser
• Klossete gange, muskelsvakhet og rykninger i muskulaturen
• Lysskyhet, overfølsomhet for støy og berøring
• Lavere terskel for følelsesmessig overbelastning, som kan føre til «crash»perioder og angst.
6 Minst ett symptom av to av de følgende kategoriene:
6A Autonome symptomer
• Ortostatisk hypotensjon – blodtrykksfall i det pasienten reiser seg
• Posturalt ortostatisk takykardi-syndrom (POTS) – hurtig puls i det pasienten reiser seg
• Ørhet
• Påtakelig blekhet
• Kvalme og irritabel tykktarm (IBS)
• Hyppig vannlating og blæreforstyrrelser
• «Urolig hjerte» (palpitasjoner) med eller uten hjerterytmeforstyrrelser
• Tung pust ved anstrengelse.
6B Nevroendokrine symptomer
• Tap av termostatisk stabilitet, subnormal kroppstemperatur og tydelige døgnsvingninger
• Svettetokter, tilbakevendende feberfølelse og kalde ekstremiteter; intoleranse for uttalt varme og kulde
• Markert vektendring, anoreksi eller unormal appetitt
• Tap av tilpasningsevne og forverring av symptomer ved belastninger
6C Immunologiske symptomer
• Ømme lymfeknuter og sår hals
• Tilbakevendende influensalignende symptomer som ofte er til stede hele tiden i varierende grad som en generell sykdomsfølelse
• Nyoppstått overfølsomhet for mat, medisiner eller kjemikalier
7 Varighet
Tilstanden må ha vart i minst seks måneder Vanligvis kan pasienten selv fastslå når sykdommen begynte, andre ganger skjer det mer gradvis. En foreløpig diagnose kan være mulig tidligere. Tre måneder er tilstrekkelig for barn. For at et symptom skal kunne regnes med, må det ha oppstått eller blitt betydelig endret etter det antatte debuttidspunktet. Det er usannsynlig at en pasient vil ha alle symptomene i punkt 5 og 6. Forstyrrelsene har en tendens til å danne symptomgrupper som kan fluktuere og endres over tid. Barn har ofte tallrike symptomer, men intensiteten synes å variere fra dag til dag.
Det finnes et lite antall pasienter som ikke har smerter eller søvnproblemer, der ingen annen diagnose passer enn CFS/ME. De canadiske kriteriene åpner for å konkludere med CFS/ME hvis pasienten ellers har et typisk sykdomsbilde og en infeksjon som utløsende årsak. Men det er ikke alltid man kan identifisere en utløsende faktor, og opp til en tredjedel har en gradvis og snikende sykdomsdebut.
Eksklusjonskriterier
En lang rekke sykdommer og tilstander kan gi kronisk utmattelse. I mangel på en klart definert biomarkør er derfor CFS/ME foreløpig en eksklusjonsdiagnose. Hovedprinsippet er at man ikke kan stille diagnosen CFS/ME dersom det foreligger aktive sykdomsprosesser som forklarer de fleste av hovedsymptomene, som utmattelse, søvnforstyrrelser, smerter og kognitiv dysfunksjon. Derfor er det ikke nok å tilfredsstille et sett med kriterier. En utredning må i tillegg alltid ha som mål å utelukke andre sykdommer, spesielt de det kan være kritisk å overse, som Addisons sykdom, Cushings syndrom, hypo- og hypertyreoidisme, jernmangel, andre former for anemi som kan behandles, hemokromatose, diabetes mellitus og kreft. Det er også nødvendig å ekskludere søvnforstyrrelser som kan behandles, likeledes obstruksjon i øvre luftveier, obstruktiv eller sentral søvnapné, autoimmune sykdommer som revmatoid artritt, systemisk lupus erythematosus, polymyositt, revmatisk polymyalgi og cøliaki. I tillegg immunsviktsykdommer som aids, nevrologiske sykdommer som multippel sklerose, Parkinsons sykdom, myasthenia gravis og B12-mangel. Til slutt infeksjonssykdommer som tuberkulose, kronisk hepatitt og borreliose, primære psykiatriske sykdommer og rusmiddelmisbruk.
Behandling
Mye tyder på at vi står overfor et paradigmeskifte. Men sannsynligvis dreier kronisk utmattelse seg om om mer enn én tilstand; det er den immunologiske sykdommen vi har beskrevet over, og som i Norge har det offisielle betegnelsen CFS/ME. Denne sykdommens hovedsymptom er PEM (Post Exertional Malaise), og ved behandling og oppfølging er det avgjørende at pasientens grad av PEM tas hensyn til, første steg er alltid å få til en maksimal aktivitetsavpassing og energiøkonomisering.
Whiting og medarbeidere gjennomførte en metaanalyse, en systematisk gjennomgang av 350 studier som omhandler ulike typer av behandling. De fant at bare 44 av disse kunne kalles kontrollerte studier (33). Og seleksjonskriteriene til de fleste av disse studiene var så vide at mange med psykosomatiske lidelser som ikke tilfredsstilte Canada-kriteriene, var inkludert. Ikke overraskende fant de at de eneste to intervensjonene som ble funnet å ha effekt, var kognitiv atferdsterapi og visse former for treningsterapi. Men ingen av disse så ut til å være kurative, de påvirket ikke energinivået i nevneverdig grad, men ga økt mestringsevne og livskvalitet.
Trening
Hos få andre pasientgrupper er effekten av trening i så høy grad avhengig av hva slags type trening det er snakk om, og ikke minst av hvor tilpasset treningen er til den enkeltes energinivå. Å kjøre CFS/ME-pasientene igjennom et standard treningsopplegg er ofte direkte skadelig, og kan redusere deres funksjonsnivå vesentlig i lang tid (34). Jones og medarbeidere gjorde en arbeidsbelastningstest to dager etter hverandre og fant at CFS/ME-pasientene hadde et redusert oksygen opptak i muskulatur etter den andre dagen. Kontrollgruppen hadde, i likhet med det man tidligere har funnet hos de fleste grupper av kronisk syke pasienter, et stabilt eller økt oksygenopptak dag 2 (35). Dette er et spennende funn også fordi det er den første variabelen som objektivt skiller CFS/ME-pasienter fra andre pasientgrupper. På den andre siden viser flere studier at langvarig mangel på mosjon forverrer den fysiske svakheten. Det er særlig to prinsipper fysioterapeuter har benyttet seg av i møte med CFS/ME-pasienter (36):
• Ved gradert treningsterapi (GET) øker man forsiktig og gradvis intensiteten i treningen. En metaanalyse av fem randomiserte studier fant at pasienter som fikk GET, var mindre slitne etter 12 uker enn kontrollgruppene, men etter seks måneder så det ut som denne forskjellen forsvant, og funksjonell arbeidskapasitet ble ikke varig bedre. GET har kommet i vanry i mange CFS/ME-miljøer fordi metoden har vært påtvunget pasienter uten å ta hensyn til graden av PEM. Men GET har èn viktig plass; når pasienten er i en tydelig bedringsfase. Da er det naturlig å gradvis øke aktivitetsnivået. I alle andre faser er det pacing som bør være hovedprinsippet.
• Pacing baserer seg på å utnytte den mengden eller «konvolutten» av energi pasienten til enhver tid har, å unngå å provosere frem ytterligere utmattelse ved å utfordre grensene for det pasienten kan klare. Det er to former: symptom-contingent pacing, der beslutningen om å stoppe eller endre en aktivitet bestemmes av en forverring av symptomer, og time-contingent pacing, som følger en fastsatt plan med aktiviteter der pasienten på forhånd anslår hvor lenge hun vil være i stand til å gjennomføre treningen uten å utløse sykdomsfølelse etter anstrengelse. Det er 70 % regelen som er det overordnede prinsippet for pacing, at pasienten ikke skal ta ut mer enn 70 % av den energien de har til rådighet.
Kognitiv terapi
Det andre elementet Whiting og medarbeidere fant at hadde effekt på forløpet av CFS/ME, var kognitiv terapi (33). Det er viktig med en støttende tilnærming. Å bli rammet av CFS/ME oppleves av mange som å miste fotfestet i livet, å være forhindret fra å gjøre det andre mennesker betrakter som en selvfølge. Alvorlighetsgraden varierer betydelig, men en felles opplevelse er at det i kjølvannet av CFS/ME står en endeløs rekke av tap. Pasientene opplever å ikke kunne delta i arbeidslivet eller fortsette studier. De mister venner og sosialt liv (37). Ofte opplever pasientene også økonomiske problemer fordi det er en møysommelig prosess å komme frem til CFS/ME-diagnosen og, i et helsebyråkrati som tradisjonelt har sett med mistro på denne pasientgruppen, få anerkjennelse for at man faktisk er syk. Mange pasienter er unge og i etableringsfasen og har ikke opparbeidet seg samme rettigheter som andre mer etablerte arbeidstakere (38).
Medikamenter og dietter
En rekke medikamenter og spesielle dietter har vært undersøkt hos pasienter med CFS/ME. Gjennom mitt arbeid med de aller dårligste pasientene ved Røysumtunet har jeg utviklet en fire trinns behandlingsprotokoll, som jeg også benytter som et utgangspunkt for min behandling og oppfølging ved Bærum CFS/ME og borrelioseklinikk. Jeg er også koordinator for en nordisk gruppe av spesialister som arbeider med en felles nordisk behandingsprotokoll, og benytter også elementer som tegner seg som lovende ut fra dette samarbeidet. Det er ikke naturlig å nevne enkeltelementer fra disse protokollene her på nettsidene, fordi hver pasient krever en unik strategi som bare kan bli til ved personlig oppfølging.
Behandleren i møte med CFS/ME-pasienten
Å møte CFS/ME-pasienten kan være krevende, først og fremst fordi man ofte møter et menneske i krise, ofte av eksistensiell art. Det kan være fristende å unngå disse pasientene, enten ved å sende dem videre til spesialister eller ved å signalisere at man ikke er interessert (51). Men det er også mulig å bety en stor forskjell, å være en medvandrer i et vanskelig landskap. Selv om jeg opplever at mange blir bedre ved å følge de strategiene jeg anbefaler, er det stor spredning i hvor effektiv behandlingen virker og hvor mye bedring som sees hos den enkelte pasient. Det naturlige forløpet av CFS/ME er at sykdommen kan ha høyst variabel alvorlighetsgrad og varighet, og et svingende forløp med tilbakeslag er det vanlige. Min erfaring er at det viktigste er å ta pasienten på alvor, å få en allianse der hovedprinsippet er å være grundig og ærlig.
Man skulle forvente at de fleste pasienter med CFS/ME utvikler psykiske problemer forbundet med sine fysiske begrensninger og opplevelse av manglende livskvalitet. Jeg blir imidlertid stadig overrasket over hvor mye livsmot og optimisme jeg møter. Det er et mindretall av pasientene mine som opplever seg som deprimerte, de beskriver det heller som en frustrasjon eller sorg over alt de ikke kan gjøre. Men det er viktig å avdekke sekundær depresjon i de få tilfellene denne er tilstede, og igangsette adekvat behandling.
Det kan være vanskelig dersom utredningen med rimelig sikkerhet har utelukket somatisk sykdom, og pasienten heller ikke ser ut til å ha CFS/ME.
Det er viktig å fremholde at CFS/ME er en immunologisk sykdom, at den ikke har psykosomatiske årsaker. Men i de tilfellene utredningen munner ut i at det dreier seg om en psykosomatisk problematikk, er det viktig å være ærlig og formidle dette. Pasienten har ofte bygd opp et solid forsvarsverk mot psykosomatiske forklaringsmodeller, og det kan være en lang vei å gå før man kan få pasienten til å akseptere at tilstanden har psykiske årsaker. I en slik prosess hender det ikke sjelden at alliansen med behandleren går i stykker. Pasienten vil ofte bryte opp og lete etter enda en terapeut, gjerne innen alternativ medisin, som fortsetter å lete etter somatiske forklaringer. Dessverre finnes mange eksempler på behandlere som beveger seg i grenselandet mellom skolemedisin og alternativ medisin, og som benytter seg av både diagnostiske tester og behandling som har mangelfull dokumentasjon når det gjelder pålitelighet og effekt. Ofte påføres pasienten store utgifter.
Prognose
Etter akutt eller snikende innsykning følger en akuttfase med utpregede symptomer selv i hvile. Etter hvert kommer vanligvis en restitusjonsfase. Det finnes en god del studier som følger CFS/ME-pasienter over tid. Når det gjelder prognose, spriker disse betydelig. Dette både fordi de kriteriene som benyttes for å definere pasientgruppen, er forskjellige, og fordi man bruker ulike kriterier for å definere hva som regnes som bedring eller helbredelse. En systematisk gjennomgang av 14 studier fant i gjennomsnitt at kun 5 % (0–31 %) ble helt friske, mens 39,5 % etter hvert ble bedre (8–63 %). Mellom 8 og 30 % kom tilbake i arbeid igjen. Barn hadde gjennomgående en bedre prognose; mellom 54 og 94 % ble friske (52). Det var imidlertid en relativt kort oppfølgingstid i disse studiene, og vi vet at CFS/ME-pasienter kan bruke lang tid på å bli friske.
En av studiene som fulgte pasientene lengst, ble utført av Brown og medarbeidere i 2012. Den fant at etter 25 år regnet 80 % av pasientene seg ikke lenger som syke. Det er imidlertid høyst individuelt når en slik bedring inntreffer, og så mye som 20 % av pasientene var ikke friske selv etter 25 år (53).
En studie så på hvilke faktorer som bidrar til en dårligere prognose (54):
• Mer enn åtte medisinsk uforklarlige fysiske symptomer
• Tidligere depresjoner
• Mer enn 1,5 års kronisk utmattelse
• Mindre enn 16 års formell utdanning
• Alder over 38 år ved presentasjon
• Pasienten hadde hektet seg opp i at sykdommen har en bestemt fysisk årsak
Til slutt må det være lov å hevde at det er mye gledelig som har skjedd på CFS/ ME-fronten de siste årene. Det har blitt en helt annen forståelse i samfunnet for at disse pasientene virkelig er alvorlig somatisk syke. Det forskes mye, og nå legges bit for bit i det store puslespillet der man tydelig ser konturene av en sykdom der immunsystemet har en sentral plass.
Mange CFS/ME pasienter er ressurssterke og begavede mennesker. Jeg har fått lov til å formidle noe av dette fra to av mine pasienter, tegneren og illustratøren Marte Jørgensen og sangeren Hanna Gravdal:
Referanser
1 Wyller V.B. (2007). The Chronic Fatigue Syndrome – An Update. Acta Neurol Scand Suppl 187: 7–14.
2 Beard G. (1869). Neurasthenia, or Nervous Exhaustion. Boston Med Surg J 1: 217–221.
3 Gilliam A. (1938). Epidemiological Study on an Epidemic, Diagnosed as Poliomyelitis, Occurring Among the Personnel of Los Angeles County General Hospital During the Summer of 1934. United States Treasury Department Public Health Service Public Health Bulletin 240: 1–90.
4 Patarca-Montero R (2004). Medical Etiology, Assessment, and Treatment of Chronic Fatigue and Malaise. London: Haworth Press.
5 Melvin Ramsay A. (1986). Postviral Fatigue Syndrome. The Saga of Royal Free Disease. London: Gower.
6 Pellew R.A., Miles J.A. (1955). Further Investigations on a Disease Resembling Poliomyelitis Seen in Adelaide. Med J Aust 2 (13): 480–482.
7 Wallis A. (1957). An Investigation Into an Unusual Illness Seen in Epidemic and Sporadic Form in a General Practice in Cumberland in 1955 and Subsequent Years. Edinburgh: Edinburgh University.
8 Richardson J. (2002). Myalgic Encephalomyelitis: Guidelines for Doctors. J Chron Fatigue Syndr 10 (1): 65–80.
9 Carruthers B.M., van de Sande, M.I. De Meirleir K.L. et al. (2011). Myalgic Encephalomyelitis: International Consensus Criteria. J Intern Med 270 (4): 327–338.
10 Gallagher A.M., Thomas J.M., Hamilton W.T. et al. (2004). Incidence of fatigue symptoms and diagnoses presenting in UK primary care from 1990 to 2001. J R Soc Med 97 (12): 571–575.
11 Poeschla B., Strachan E., Dansie E., et al. (2013). Chronic Fatigue and Personality: A Twin Study of Causal Pathways and Shared Liabilities. Ann Behav Med 45 (3): 289–298.
12 Cifuentes R.A., Barreto E. (2011). Supervised Selection of Single Nucleotide Polymorphisms in Chronic Fatigue Syndrome. Biomedica 31 (4): 613–621.
13 Smith A.K., Fang H., Whistler T. et al. (2011). Convergent Genomic Studies Identify Association Of GRIK2 and NPAS2 with Chronic Fatigue Syndrome. Neuropsychobiol 64 (4): 183–194.
14 Kato K., Sullivan P.F., Evengard B., Pedersen N.L. (2006). Premorbid Predictors of Chronic Fatigue. Arch Gen Psychiatry 63 (11): 1267–1272.
15 Heim C., Wagner D., Maloney E. et al. Early Adverse Experience and Risk for Chronic Fatigue Syndrome. Arch Gen Psychiatry 63 (11): 1258–1266.
16 Dansie E., Heppner P., Furberg H. et al. (2012). The Comorbidity of SelfReported Chronic Fatigue Syndrome, Posttraumatic Stress Disorder, and Traumatic Symptoms. Psychosomatics 53 (3): 250–257. 17 Salit I.E. (1997).
17 Precipitating Factors for the Chronic Fatigue Syndrome. J Psychiatric Res 31 (1): 59–65.
18 Mueller C, Lin JC, Sheriff S, Maudsley AA, Younger JW. Evidence of widespread metabolite abnormalities in Myalgic encephalomyelitis/chronic fatigue syndrome: assessment with whole-brain magnetic resonance spectroscopy. Brain Imaging Behav. 2020;14(2):562-572. doi:10.1007/s11682-018-0029-4.
19 Hollingsworth K.G., Jones D.E., Taylor R. et al. (2010). Impaired Cardiovascular Response to Standing in Chronic Fatigue Syndrome. Eur J Clin Invest 40 (7): 608–615.
20 Streeten D.H., Thomas D., Bell D.S. (2000). The roles of Orthostatic Hypotension, Orthostatic Tachycardia, and Subnormal Erythrocyte Volume in the Pathogenesis of the Chronic Fatigue Syndrome. Am J Med Sci 320 (1): 1–8.
21 Wyller V.B., Eriksen H.R., Malterud K. (2009). Can Sustained Arousal Explain the Chronic Fatigue Syndrome? Behavioral and Brain Functions. BBF 5: 10.
22 Papadopoulos A.S., Cleare A.J. (2011). Hypothalamic-Pituitary-Adrenal Axis Dysfunction in Chronic Fatigue Syndrome. Nat Rev Endocrinol 8 (1): 22–32.
23 Snell C.R., Stevens S.R., Davenport T.E., Van Ness J.M. (2013). Discriminative Validity of Metabolic and Workload Measurements for Identifying People with Chronic Fatigue Syndrome. Phys Ther 93 (11): 1484–1492.
24 Newton D.J., Kennedy G., Chan K.K. et al. (2011). Large and Small Artery Endothelial Dysfunction In Chronic Fatigue Syndrome. Int J Cardiol 153 (3): 335–336.
25 Klimas N.G., Koneru A.O. (2007). Chronic Fatigue Syndrome: Inflammation, Immune Function, and Neuroendocrine Interactions. Curr Rheumatol Rep 9 (6): 482–487.
26 Aspler A.L., Bolshin C., Vernon S.D., Broderick G. (2008). Evidence of Inflammatory Immune Signaling in Chronic Fatigue Syndrome: A Pilot Study of Gene Expression in Peripheral Blood. Behav Brain Funct 4: 44.
27 Broderick G., Fuite J., Kreitz A. et al. (2010). A Formal Analysis of Cytokine Networks in Chronic Fatigue Syndrome. Brain Behav Immun 24 (7): 1209–1217.
28 Pall M.L., Satterlee J.D. (2001). Elevated Nitric Oxide/Peroxynitrite Mechanism for the Common Etiology of Multiple Chemical Sensitivity, Chronic Fatigue Syndrome, and Posttraumatic Stress Disorder. Ann N Y Acad Sci 933: 323–329.
29 Fluge O., Bruland O., Risa K. et al. (2011). Benefit from B-Lymphocyte Depletion Using the Anti-CD20 Antibody Rituximab in Chronic Fatigue Syndrome. A Double-Blind and Placebo-Controlled Study. PLoS One 6 (10): E26358.
30 Carruthers B.M., van de Sande, M.I. De Meirleir K.L. et al. (2012). Myalgisk encefalomyelitt: Internasjonale konsensuskriterier. Oslo: Helsedirektoratet.
31 Reeves W.C., Wagner D., Nisenbaum R. et al. (2005). Chronic Fatigue Syndrome A Clinical Empirical Approach to Its Definition and Study. BMC Medicine 3: 19.
32 Carruthers B.M., Jain A.K., De Meirleir K.L. et al. (2003). Myalgic Encephalomyelitis/Chronic Fatigue Syndrome: Clinical Working Case Definition, Diagnostic and Treatments Protocols. J Chron Fatigue Syndrome 11: 7–115.
33 Whiting P., Bganall A.M., Sowden A.J. et al. (2001). Interventions for the Treatment and Management of Chronic Fatigue Syndrome: A Systematic Review. JAMA. 286 (11): 1360–1368.
34 White A.T., Light A.R., Hughen R.W. et al. (2012). Differences in MetaboliteDetecting, Adrenergic, and Immune Gene Expression After Moderate Exercise in Patients with Chronic Fatigue Syndrome, Patients with Multiple Sclerosis, and Healthy Controls. Psychosom Med 74 (1): 46–54.
35 Jones D.E., Hollingsworth K.G., Jakovlevic D.G. et al. (2012). Loss of Capacity to Recover from Acidosis on Repeat Exercise in Chronic Fatigue Syndrome: A Case-Control Study. Eur J Clin Invest 42 (2): 186–194.
36 White P.D., Goldsmith K.A., Johnson A.L et al. (2011). Comparison of Adaptive Pacing Therapy, Cognitive Behaviour Therapy, Graded Exercise Therapy, and Specialist Medical Care for Chronic Fatigue Syndrome (PACE): A Randomised Trial. Lancet 377 (9768): 823–836.
37 Goudsmit E.M., Stouten B., Howes S. (2009). Illness Intrusiveness in Myalgic Encephalomyelitis: An Exploratory Study. J Health Psychol 14 (2): 215–221.
38 Shepherd C. (2006). The Debate: Myalgic Encephalomyelitis and Chronic Fatigue Syndrome. Br J Nurs 15 (12): 662–669.
39 Straus S.E. (2004). Pharmacotherapy of Chronic Fatigue Syndrome: Another Gallant Attempt. JAMA 292 (10): 1234–1235.
40 McDermott C., Richards S.C., Thomas P.W. et al. (2006). A Placebo-Controlled, Double-Blind, Randomized Controlled Trial of a Natural Killer Cell Stimulant (Biobran MGN-3) in Chronic Fatigue Syndrome. QJM 99 (7): 461–468.
41 Blacker C.V., Greenwood D.T., Wesnes K.A. et al. (2004). Effect of Galantamine Hydrobromide in Chronic Fatigue Syndrome: A Randomized Controlled Trial. JAMA 292 (10): 1195–1204.
42 DuBois R.E. (1986). Gamma Globulin Therapy for Chronic Mononucleosis Syndrome. AIDS Res, 2 Suppl 1: S191–195.
43 Peterson P.K., Shepard J., Macres M.et al. (1990). A Controlled Trial of Intravenous Immunoglobulin G in Chronic Fatigue Syndrome. Am J Med 89 (5): 554–560.
44 Straus S.E., Dale J.K., Tobi M. et al. (1988). Acyclovir Treatment of the Chronic Fatigue Syndrome. Lack of Efficacy in a Placebo-Controlled Trial. N Engl J Med 319 (26): 1692–1698.
45 Vercoulen J.H., Swanink C.M., Zitman F.G. et al. (1996). Randomised, DoubleBlind, Placebo-Controlled Study of Fluoxetine in Chronic Fatigue Syndrome. Lancet 347 (9005): 858–861.
46 Reid S., Chalder T., Cleare A. et al. (2000). Chronic Fatigue Syndrome. BMJ 320 (7230): 292–296.
47 Randall D.C., Cafferty F.H., Shneerson J.M. et al. (2005). Chronic Treatment with Modafinil May Not Be Beneficial in Patients with Chronic Fatigue Syndrome. J Psychopharmacol 19 (6): 647–660.
48 Blockmans D., Perssons P., Van Houdenhove B., Bobbaers H. (2006). Does Methylphenidate Reduce the Symptoms of Chronic Fatigue Syndrome? Am J Med 119 (2): 167 e23–3.
49 McKenzie R., O’Fallon A., Dale J. et al., (1998). Low-Dose Hydrocortisone for Treatment of Chronic Fatigue Syndrome: A Randomized Controlled Trial. JAMA 280 (12): 1061–1066.
50 Lapp C.W., Cheney P.R. (1995). Chronic Fatigue Syndrome. Ann Intern Medicine 123 (1): 74–75.
51 Chew-Graham C., Dowrick C., Wearden A. et al. (2010). Making the Diagnosis of Chronic Fatigue Syndrome/Myalgic Encephalitis in Primary Care: A Qualitative Study. BMC Fam Pract 11: 16.
52 Joyce J., Hotopf M., Wessely S. (1997). The Prognosis of Chronic Fatigue and Chronic Fatigue Syndrome: A Systematic Review. QJM 90 (3): 223–233.
53 Brown M.M., Bell D.S., Jason L.A. et al., (2012). Understanding Long-Term Outcomes of Chronic Fatigue Syndrome. J Clin Psychol 68 (9): 1028–1035.
54 Jason L.A., Taylor R.R., Kennedy C.L. et al., (2002).A Factor Analysis of Chronic Fatigue Symptoms in a Community-Based Sample. Soc Psychiatry Psychiatr Epidemiol 37 (4): 183–189.
55 Loebel M, Grabowski P, Heidecke H et al. Antibodies to β adrenergic and muscarinic cholinergic receptors in patients with Chronic Fatigue Syndrome. Brain Behav Immun 2016; 52: 32 – 9.
56. Fluge Ø, Mella O, Bruland O et al. Metabolic profiling indicates impaired pyruvate dehydrogenase function in myalgic encephalopathy/chronic fati-
gue syndrome.JCllnsight 2016;1; e89376.
57. Cabanas H, Muraki K, Balinas C, Eaton-Fitch N, Staines D, Marshall-Gradisnik S. Validation of impaired Transient Receptor Potential Melastatin 3 ion channel activity in natural killer cells from Chronic Fatigue Syndrome/ Myalgic Encephalomyelitis patients. Mol Med. 2019;25(1):14. Published 2019 Apr 23.
58. Esfandyarpour, A. Kashi, M. Nemat-Gorgani, J. Wilhelmy, R. W. Davis. A nanoelectronics-blood-based diagnostic biomarker for myalgic encephalomyelitis/chronic fatigue syndrome (ME/CFS) Proceedings of the National Academy of Sciences May 2019, 116 (21) 10250-10257
59. Germain A, Ruppert D, Levine SM, Hanson MR. Metabolic profiling of a myalgic encephalomyelitis/chronic fatigue syndrome discovery cohort reveals disturbances in fatty acid and lipid metabolism. Mol Biosyst. 2017;13(2):371–379. doi:10.1039/c6mb00600k